Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi (Biloks)
Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi
Langkah penyetaraan cara bilangan oksidasi :
1. Tentukan bilangan oksidasi atom-atom yang mengalami reaksi redoks
2. Tentukan selisih bilangan oksidasi atom-atom yang mengalami reaksi redoks
3. Kalikan silang dengan selisih bilangan oksidasi pada atom/ion/senyawa yang mengalami perubahan bilangan oksidasi
4. Setarakan jumlah muatan dengan menambah H+ pada yang muatannya lebih kecil.
5. Setarakan jumlah atom H dengan menambah H2O
6. Jika suasana asam, penyetaraan selesai. Jika suasana basa, H+ harus diganti dengan OH- dengan cara sebagai berikut :
- Tambahkan OH- pada kedua ruas sebanyak H+
- Gabungkan H+ dengan OH- menjadi H2O
- Kurangi kelebihan H2O
Contoh 1
Setarakan reaksi berikut :
1. Fe2+ + MnO4- → Fe3+ + Mn2+ ( suasana asam )
2. rO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3 ( suasana basa )
3. Cr2O72- + SO2 → 2 Cr3+ + HSO4-
Jawab
1. Fe2+ + MnO4- → Fe3+ + Mn2+ ( suasana asam )
Langkah 1 & 2
a. Tentukan bilangan oksidasi atom-atom yang mengalami reaksi redoks
Bilangan oksidasi (biloks) Mn berubah dari +7 menjadi +2 terjadi perubahan biloks 5 satuan Bilangan oksidasi (biloks) Fe berubah dari +2 menjadi +3 terjadi perubahan biloks 1 satuan
Langkah 3
b. Kalikan silang dengan selisih bilangan oksidasi pada spesi yang mengalami
perubahan bilangan oksidasi
perubahan bilangan oksidasi
Kaprikornus Mn dikalikan 1 dan Fe dikalikan 5, sehingga reaksi menjadi :
5Fe2+ + MnO4- → 5Fe3+ + Mn2+
+10 -1 +15 +2 (Muatan )
Muatan kiri = +9
Muatan kanan = +17
Muatan kanan = +17
c. Karena muatan ruas kiri < muatan ruas kanan, maka ditambahkan ion H+
Maka tambahkan 8H+ di ruas kiri (yang muatannya lebih kecil)
Langkah 4
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+
d. Setarakan H dengan menambah H2O secukupnya
Karena di ruas kiri terdapat 8H+ maka di ruas kanan ditambahkan 4H2O
Karena di ruas kiri terdapat 8H+ maka di ruas kanan ditambahkan 4H2O
Langkah 5
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
e. Hitung O di ruas kiri dan di ruas kanan. pada pola di atas jumlah atom O di ruas kiri = 4 dan jumlah atom O di ruas kanan = 4. Jadi, reaksi sudah setara
e. Hitung O di ruas kiri dan di ruas kanan. pada pola di atas jumlah atom O di ruas kiri = 4 dan jumlah atom O di ruas kanan = 4. Jadi, reaksi sudah setara
Contoh 2
CrO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3 ( suasana basa )
Langkah 1 & 2
2CrO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3
+12 +2 +6 +3
Biloks Cr berubah dari +12 menjadi +6 , jadi selisih biloks Cr = +6
Biloks Fe berunbah dari +2 menjadi +3 , jadi selisih biloks = +1
Kalikan silang berdasarkan selisih biloks yang terjadi. Spesi yang mengandung Cr dikalikan 1 sedangkan spesi yang mengandung Fe dikalikan 6 sehingga reaksi menjadi
2CrO42- + 6Fe(OH)2 → Cr2O3 + 6Fe(OH)3
Langkah 3
2CrO42- + 6Fe(OH)2 → Cr2O3 + 6Fe(OH)3
-4 0 0 0
Tambahkan H+ pada yang muatannya kecil
Karena muatan ruas kiri = -4 dan muatan ruas kanan = 0, maka
Karena muatan ruas kiri = -4 dan muatan ruas kanan = 0, maka
Muatan ruas kiri < muatan ruas kanan.
Kaprikornus pada ruas kiri ditambahkan 4H+
Kaprikornus pada ruas kiri ditambahkan 4H+
sehingga reaksi yang terjadi menjadi
2CrO42- + 6Fe(OH)2 + 4H+ → Cr2O3 + 6Fe(OH)3
Hitung jumlah H.
Karena jumlah H ruas kiri = 16 dan jumlah H ruas kanan = 18, maka ditambahkan H2O
pada ruas kiri, sehingga terbentuk reaksi
2CrO42- + 6Fe(OH)2 + 4H+ + H2O → Cr2O3 + 6Fe(OH)3
Hitung jumlah H.
Karena jumlah H ruas kiri = 16 dan jumlah H ruas kanan = 18, maka ditambahkan H2O
pada ruas kiri, sehingga terbentuk reaksi
2CrO42- + 6Fe(OH)2 + 4H+ + H2O → Cr2O3 + 6Fe(OH)3
Langkah 4 : 2CrO42- + 6Fe(OH)2 + 4H+ + H2O → Cr2O3 + 6Fe(OH)3
Langkah 5 : 2CrO42- + 6Fe(OH)2 + 4H+ + H2O → Cr2O3 + 6Fe(OH)3
Karena reaksi dalam suasana basa, maka harus dibuat dalam suasana basa (OH-), dengan menambah OH- sebanyak H+ yang ada pada kedua ruas.
2CrO42- + 6Fe(OH)2 + 4H+ + H2O + 4 OH- →Cr2O3 + 6Fe(OH)3 + 4 OH-
2CrO42- + 6Fe(OH)2 + 4 H2O + H2O + 4 OH- → Cr2O3 + 6Fe(OH)3 + 4 OH-
2CrO42- + 6Fe(OH)2 + 5 H2O → Cr2O3 + 6Fe(OH)3 + 4 OH-
Penyetaraan Reaksi Redoks dengan Metode BILOKS dalam suasana ASAM
Contoh Soal 1
Setarakan reaksi berikut dengan metode biloks dalam suasana asam :
Cr2O72- + Fe2+ → Cr3+ + Fe3+
Contoh Soal 2
Setarakan reaksi berikut dengan metode biloks dalam suasana asam
Fe2+ + MnO4- → Fe3+ + Mn2+
Contoh Soal 3
Setarakan reaksi berikut dengan metode biloks dalam suasana asam
ClO- + Bi2O3 → Cl- + BiO32-
Contoh Soal 4
Setarakan reaksi berikut dengan metode biloks dalam suasana asam
MnO + PbO2 → MnO4- + Pb2+
Contoh Soal 5
Setarakan reaksi berikut dengan metode biloks dalam suasana asam
Cr2O72- + C2O42- → Cr3+ + CO2
Penyetaraan Reaksi Redoks dengan Metode BILOKS dalam suasana BASA
Contoh Soal 1
Setarakanlah reaksi redoks berikut dengan metode biloks suasana basa
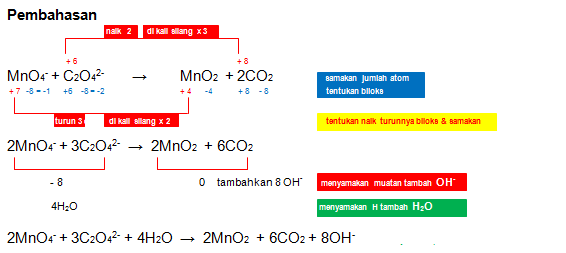
MnO4- + C2O42- → MnO2 + CO2
Contoh Soal 2
Setarakanlah reaksi redoks berikut dengan metode biloks suasana basa
CrO42- + Fe(OH)2 → Cr2O3 + Fe(OH)3
Contoh Soal 3
Setarakanlah reaksi redoks berikut dengan metode biloks suasana basa
Cl2 + IO3- → Cl- + IO4-
Contoh Soal 4
Setarakanlah reaksi redoks berikut dengan metode biloks suasana basa
Zn + NO3- → ZnO22- + NH3
Contoh Soal 5
Setarakanlah reaksi redoks berikut dengan metode biloks suasana basa
Cr(OH)3 + H2O2 → CrO4-2- + H2O
<<LANJUTKAN MATERI >>











0 Response to "Penyetaraan Reaksi Redoks dengan Cara Bilangan Oksidasi (Biloks)"
Post a Comment